专利分析提高医药研发精度——以双特异性抗体分析为例总第197期,李佳芮 夏文广发表,[专利]文章 |
专利分析提高医药研发精度——以双特异性抗体分析为例
李佳芮
路浩集团资深分析师
夏文广
路浩集团法务咨询中心副总经理
医药行业技术创新成果的保护主要依赖于专利的布局,针对生物制药专利家族的分析,不仅可以从一定程度上反映目前研究的重点领域、技术热点或空白点,还可从中了解技术发展情况以及未来研发趋势。本文阐述了专利分析在药品研发过程中的重要作用,指出药品生命周期中各阶段可选择的专利分析方向,以双特异性抗体为例给出了药品在早期立项、研发阶段的专利技术分析维度,通过梳理专利布局脉络、分析专利地域布局策略的方式给出技术研发方向,以此预防未来可能出现的侵权风险,并阐释了专利信息分析在医药企业的产品开发、技术研发的过程中针对技术风险防控的重要意义。
“药品专利分析”应用阶段
当今生命科学相关技术发展日新月异,生物医药领域的技术更新迭代较快,每年全球范围内申请的生物医药相关专利达上万件,涉及抗体、疫苗、融合蛋白、细胞治疗以及基因疗法等多个方面,相关产品也因生物药独具的高安全性和强有效性越来越获得市场以及患者认可。作为极具竞争力的新兴产业,医药领域的热点技术创新、传统技术突破也成为世界各大药企争先布局专利的焦点。
医药技术研发过程中,相关药品专利分析贯穿于整个药品生命周期,具体可以分为立项、研发、注册、上市以及上市后五个阶段(见图1)。其中,在立项阶段,对具体技术领域进行专利全景分析、具体技术的查新检索、准备立项的药品专利布局分析、未来可能存在的侵权风险排查分析;在研发阶段的药品专利分析,主要涉及专利布局规划、专利挖掘、专利撰写、专利申请以及专利授权前景分析。
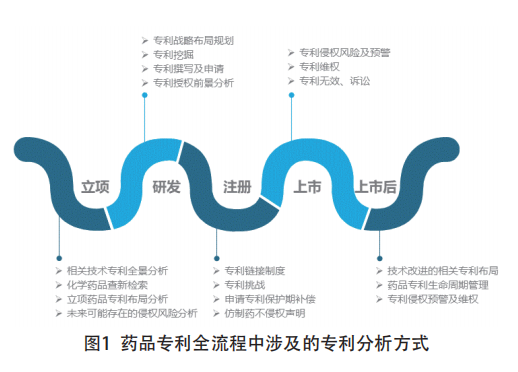
在药品注册、上市以及上市以后的过程中,则主要涉及针对相关药品专利权的法律分析或评估,相关的法律法规主要有药品专利期限补偿制度、药品专利链接制度等。
药品专利技术分析:以双特异性抗体为例
双抗药品上市进入爆发期,市场规模逐渐扩张
2022年全球上市的双抗药物数量超过过去12年的总和。目前,国内已有超30家生物医药企业布局双抗药物管线、300余款双抗在研药物,近100款双抗药物进入临床阶段。
重点关注创新(双抗)药品专利布局,谋定而后动
药品行业投资大、风险高、周期长,对技术依赖程度高,其发展高度依赖专利技术保护。基于此,针对双特异性抗体的专利技术分析,对了解该领域的研发方向、发展水平具有较强的现实借鉴意义。
双特异性抗体药物领域的专利分析可以从国内外技术发展态势、技术热点以及未来发展方向等角度出发,亦可结合该领域平台技术、靶点分布、适应症布局等技术层面,梳理其技术发展路线。通过对重点竞争对手相关专利的技术分析,可以了解该领域主要技术发展程度,为自身技术研发、专利布局指引方向,还可为企业合作开发、市场战略布局规划提供参考。
全球双特异性抗体领域专利申请量整体呈现增长态势(见图2)。自1975年杂交瘤技术建立后,基于此项技术的双特异性抗体相关研究开始出现;缓慢发展至2000年以后,专利申请数量明显增加,2005年至2014年相关专利数量出现明显波动增长态势,这十年内年申请量平均达100件左右。自2015年以后,专利数量增长迅猛,并在2019年达到峰值,这一年的申请量为939件。因为近两年专利数据公开的不完整性,预测未来双特异性抗体的专利数量将屡创新高。
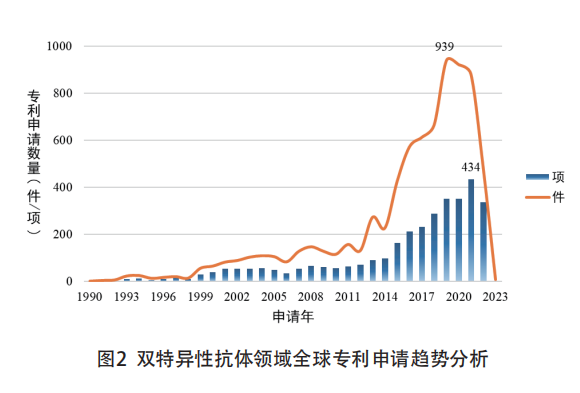
另外,因为药品专利技术研发保护依赖性强,各大制药厂商更倾向于针对一项技术布局多件相关专利,由此表现出专利件和项在数量上的明显差别。
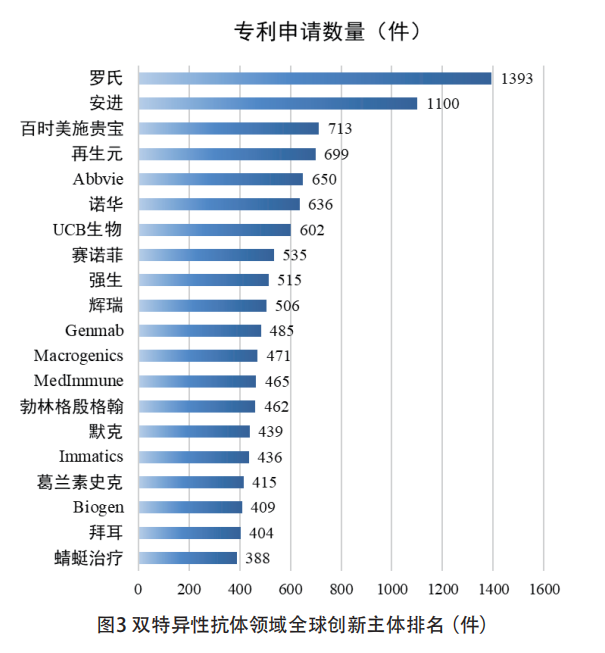
医药行业中,具有较强技术创新实力的创新主体可以看作能够引领行业发展的宝贵资源。在双特异性抗体领域中,作为“领头羊”的罗氏集团共计申请1393件相关专利,远超排名第二的安进。从申请人国别来看,前20名申请人中,美国占据10个席位,且未见中国申请人入选(见图3)。由此可见,美国申请人具有较强的创新实力,中国申请人与美国申请人相比创新实力还存在较大差距。从全球专利申请人的类型来看,大型生物制药企业具有绝对的优势。究其原因,抗体药物研发的技术壁垒高、研发周期长,需要雄厚的资金和强大的技术背景支持。
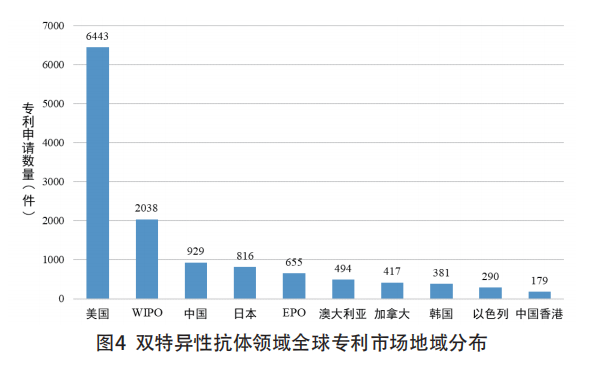
双特异性抗体药品专利市场地域布局情况,指双抗药进入的目标国家情况。美国申请的双抗药专利数量远超其他国家,一方面是因为美国是最大的抗体药物消费市场,各大制药厂商更乐于在美国布局相关专利;另一方面,作为抗体药物“领头羊”的罗氏集团,其旗下的基因泰克和分子生物学研究所都位于美国,在美国申请了大量相关专利。另外,通过PCT途径进入国际市场,也成为各创新主体重点考虑的专利布局方式。除此以外,中国、日本、韩国等亚洲市场也成为双特异性抗体的主要市场地域(见图4)。
双抗药专利技术布局,从技术维度了解重点技术研发方向
通过对双抗药靶点专利布局情况的分析,可以了解现阶段双抗药靶点的保护情况,为企业研发规避风险。企业也可结合自身研发优势调整技术方案,避免浪费研发成本。
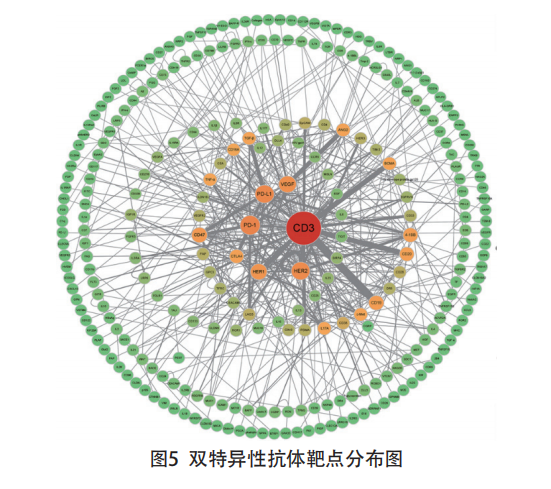
双特异性抗体的相关靶点布局主要以CD3、PD-1、PD-L1、HER2、VEGF、HER1(EGFR)等为 主。其中,针对CD3的双抗体相关研究数量最多,且多与CD19、BCMA、CD20、HER1、CD33、HER2、PSMA、EpCAM、ROR1、CEA、GPC3、CD38、CLDN18.2 等靶点相结合,构建双特异性抗体(见图5)。
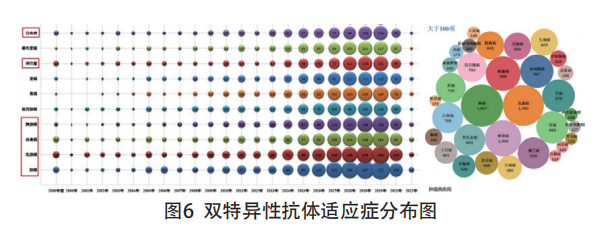
通过对专利中布局的适应症进行统计分析,可以了解双抗药领域的适应症保护情况,以及重点适应症依时间变化而受关注的程度。在对适应症的专利分析过程中,可结合靶点情况了解不同靶点针对的适应症领域,也可结合重点创新主体分析其关注的疾病治疗方向。另外,还可从重点竞争对手的技术研发路线出发,分析特定靶点在具体适应症中的技术研发情况,以此为申请人规避治疗效果差或没有技术研发前景的疾病领域。
双特异性抗体领域专利公开的适应症主要包括肺癌、乳腺癌、卵巢癌、胰腺癌和前列腺癌等。其中,针对肺癌的研发数量较多,且多为非小细胞肺癌的相关专利(见图6)。目前,该适应症在国内已有两款产品处于临床阶段,分别为康方生物的PD-1/VEGF双特异性抗体(CN112830972A)(AK112) 和 恒 瑞 医 药 的PD-L1/TGF-β双特异性抗体(CN110050000B)(SHR-1701),其相关专利均已在中国、澳大利亚、美国、韩国等多地进行申请,在部分地区已获得授权。
小结
综上,在双抗体领域,可主要从技术发展趋势、主要竞争对手以及市场地域布局等宏观角度了解该技术领域的整体发展情况,并从靶点布局、重点关注适应症等技术角度分析该领域的技术研发情况。
药品研发中的技术风险分析与防控
针对医药产品的专利布局,应自目标产品立项之初即开始进行。其间,需要做好目标产品的国内外专利文献及非专利文献的信息检索、分析及应用,并从技术保护、公开地域等多角度,进行全方位的信息查阅和解读。具体来说,药企应在前期立项时对所选定目标产品建立专利风险预警,主要涉及专利检索和分析、专利的分类和规避、专利权的法律状态和到期时间、专利技术内涵分析、专利竞争格局分析、专利风险筛查、专利风险等级判定和专利风险应对等方面。基于上述目标,则需要在前期专利信息检索过程中,对已上市或即将上市的药物专利信息进行充分、全面的调研和了解,提前找出后期开发中可能会面临的风险,以进行决策判断。
对于拥有药物或相关技术平台自主知识产权的制药企业来说,相关产品的专利布局主要应从目的性和前瞻性出发,在具体研发实践过程中,全方位、多方面考虑专利申请和保护,实行关键技术专利挖掘,对核心及外围技术进行多方面的布局保护。正所谓“兵马未动粮草先行”,医药新产品的研发离不开相关专利并行或提前布局,方能保证在产品上市后通过药品专利排他权来规避风险,实现市场垄断利润,从而反哺推动企业不断创新进步和发展,进而更加有效地投入到未来新一轮技术研发中。
参考文献
[1] 章燕.风险防控下的医药研发和知识产权布局策略[J].今日财富(中国知识产权),2021(10):22-24.
[2] 尹玲, 韦善基.医药企业专利的布局与运营[J].当代经济,2018(20):76-77+106.
[3] 董丽. 我国制药企业专利风险管理体系的构建研究[D].沈阳药科大学,2012.




